
Cell dive助力《Science》發表,參見2025年 KLF2 maintains lineage fidelity and suppresses CD8 T cell exhaustion during acute LCMV infection 一文。
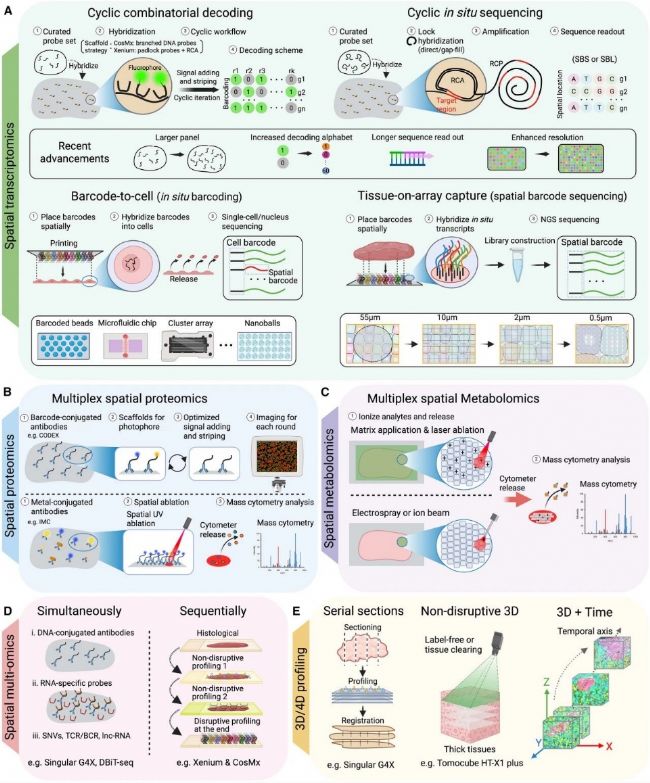
“2025年12月31日,國際期刊《Cancer Cell》發表德克薩斯大學MD安德森癌癥中心王凌華教授團隊的一篇空間組學重要綜述。文章指出空間組學技術已步入成熟期,它通過揭示腫瘤細胞與微環境在組織原位的空間組織、相互作用和演化規律,以準確的精度重塑我們對癌癥的認知。空間組學技術不僅是強大的科研工具,更逐步成為下一代精準腫瘤學的臨床基石。"
2025年2月14日,美國耶魯大學Nikhil S. Joshi課題組Eric Fagerberg , John Attanasio , Christine Dien 等學者在《Science》 發布- KLF2 maintains lineage fidelity and suppresses CD8 T cell exhaustion during acute LCMV infection,關于LCMV急性感染期間KLF2維持譜系保真度并抑制CD8 T細胞耗竭的研究。
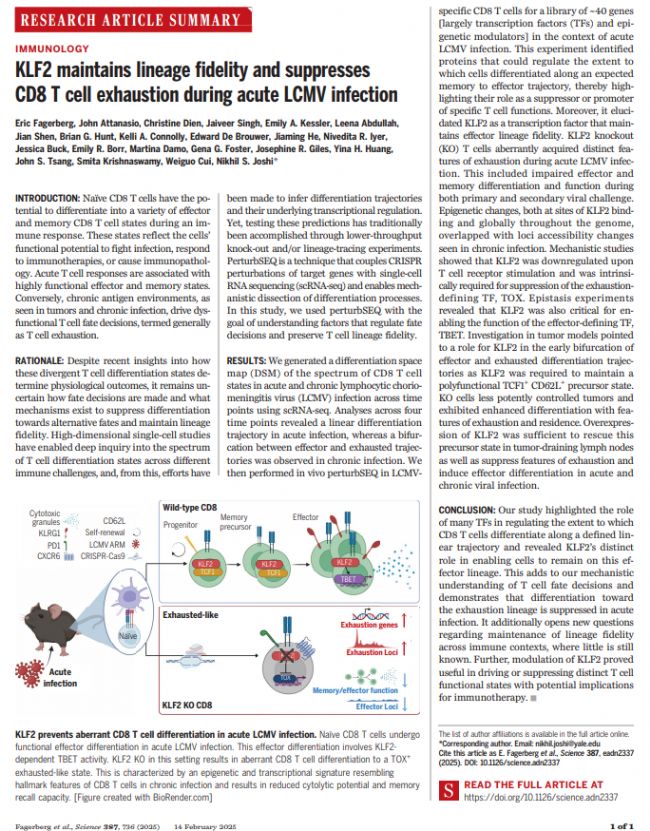
在免疫應答過程中,天然CD8 T細胞有潛力分化成功能狀態廣泛的細胞譜系。本研究采用基于CRISPR-Cas9 in vivo 核酸干擾評估T細胞命運決定中的約40種轉錄因子(TFs)和表觀遺傳調節模塊,意外發現敲除TF Klf2導致急性感染期間異常分化成耗竭樣CD8 T細胞。KLF2用來抑制促進耗竭的TF TOX,同時也是維持多功能腫瘤特異性祖細胞狀態的關鍵。該結果表明KLF2提供效應CD8 T細胞譜系保真度,抑制耗竭程序。刷新認知:傳統認為T細胞衰竭僅發生在慢性抗原環境中,本研究證明急性感染中也存在衰竭程序,但被KLF2主動抑制。
該研究構建了全面的分化空間圖譜(DSM),整合急性和慢性LCMV感染多個時間點(第4、8、28、40天)的單細胞數據,揭示急性感染呈線性分化軌跡,慢性感染呈分叉軌跡(效應vs衰竭),為理解T細胞命運決定提供了研究框架。轉化醫學意義,KLF2過表達可抑制衰竭特征并促進效應分化,為腫瘤免疫治療提供新的干預靶點。
該研究中顯微成像設備為
Cell DIVE 超多標組織成像分析系統
01產品特點
多重免疫熒光成像:可同時檢測超多標記物(可在一張切片對多達60個以上的markers成像)。
自發熒光控制:采用染料失活技術消除背景。
高分辨率:可觀察組織內細胞空間分布,結合Aivia空間分析功能,完成空間生物學超多標批量處理,快速獲得研究洞察。
02該研究中的價值
驗證異常分化的
空間生物學免疫微環境
發現KLF2缺失的T細胞在第8天更多定位在髓區,提示其分化狀態與正常效應T細胞的組織分布模式不同。
排除位置依賴性假說
分析數據支持KLF2的作用是位置獨立的,主要通過內在轉錄調控而非微環境位置決定細胞命運。
03與其他技術的互補性
顯微成像提供關鍵的空間信息,流式細胞術提供定量表型數據,單細胞測序提供轉錄組信息,ATAC-seq提供表觀遺傳信息,四者結合形成完整的研究體系。
豐富的研究方法將進一步深化細胞命運決定的理解,并可能帶來新的免疫治療策略。空間生物學,臨床應用未來!
相關產品:
 編輯搜圖
編輯搜圖
CELL DIVE 超多標組織成像分析系統
?
電話
微信掃一掃
